lorem ipsum dolor sit amet
Lorem ipsum dolor sit amet, consectetur adipiscing elit. Nunc dignissim euismod urna tincidunt sagittis. Vivamus id vehicula eros, non scelerisque eros.
Fonte: Shutterstock.
Deseja ouvir este material?
Áudio disponível no material digital.
Praticar para aprender
Caro aluno, na seção anterior falávamos sobre como ocorre a resposta imunológica. Você deve ter percebido que cada etapa depende da capacidade das células da resposta imune reconhecerem o antígeno para então exercerem sua função efetora. Vimos ainda que, diferentemente das células da resposta inata, os linfócitos T e B possuem receptores únicos e eficazes em distinguir o “próprio” do “não próprio”. Mas como eles fazem isso? Será que qualquer antígeno induz a ativação do linfócito que o reconheceu? Se você ainda não sabe essas respostas, não se preocupe. Nesta seção iremos estudar como funcionam os TCRs e BCRs. Saberemos como ocorre a interação desses receptores com o antígeno alvo e as particularidades de cada um.
O objetivo desta unidade é identificar e analisar os componentes moleculares envolvidos na ativação da resposta imune adaptativa, além de compreender como podem ser utilizados na prática clínica.
Para auxiliá-lo nesta jornada, suponha que você, já formado e dominando a área de imunologia clínica, foi convidado para integrar uma equipe multiprofissional de um grande hospital e está participando de sua primeira reunião com a equipe. O segundo caso analisado foi o do Pedro, um menino de seis anos, internado por causa de um quadro de diarreia grave. De acordo com relato dos pais, a criança apresenta uma história de pneumonias, sinusites e otites médias recorrentes, além de um episódio de estomatite grave. Os exames sanguíneos revelaram neutropenia e linfopenia de T CD4+. Os níveis séricos de imunoglobulinas também estavam alterados, com baixos níveis de IgG, IgA e IgE e níveis elevados de IgM. Foi realizada colonoscopia para investigação da possível causa do quadro diarreico, onde detectou-se colite ulcerativa inespecífica.
Após analisar os dados do paciente, você aconselhou o pediatra responsável pelo menino a solicitar um exame que avaliasse, por citometria de fluxo, a expressão de CD40L (CD154) em linfócitos T ativados. Após quatro dias, o resultado indicou que os linfócitos T do paciente expressavam menos CD40L que o controle sadio. Como você explicaria para a equipe a solicitação desse exame? A baixa expressão da molécula CD40L tem alguma relação com o quadro clínico apresentado por Pedro?
Para solucionar essa situação-problema destrincharemos, no item Não pode faltar, o funcionamento dos receptores da resposta adaptativa e sua utilização na clínica. Vamos juntos? Bons estudos!
conceito-chave
Já sabemos que as células das respostas inata e adaptativa possuem receptores com graus distintos de especificidade. Cada receptor de célula T (TCR) e de célula B (BCR) é único, sendo capaz de reconhecer apenas um fragmento, ou epítopo, do antígeno. Retomando esse conceito, antígeno corresponde a qualquer molécula que é reconhecida por um BCR ou TCR. Sua natureza bioquímica pode ser diversa, variando desde metabólitos intermediários simples, como açúcares, lipídeos, hormônios, autacoides, carboidratos complexos, fosfolipídeos, ácidos nucleicos e proteínas. Entretanto, nem todo antígeno que é reconhecido por um desses receptores é capaz de ativar um linfócito e estimular uma reação imunológica. Aqueles que o fazem são chamados de imunógenos. Você deve estar se perguntando: o que torna um simples antígeno um imunógeno? Os requisitos são diferentes para os linfócitos (T e B), e para entender melhor tudo isso, precisaremos olhar mais de perto como funcionam os receptores da resposta adaptativa.
Os TCRs e BCRs fazem parte de um enorme conjunto de receptores imunes constituídos por uma proteína de membrana, da superfamília das imunoglobulinas (Ig), associada a proteínas transmembranares cujas caudas citoplasmáticas possuem resíduos de tirosina. Esse complexo multiproteico funciona de maneira integrada, com a primeira molécula sendo responsável pela ligação ao antígeno e as demais agindo na internalização do sinal. Complicou? Então, calma! Iremos destrinchar melhor tudo isso.
Olhando primeiramente para o receptor de células T, temos um heterodímero formado por duas cadeias polipeptídicas, ligadas entre si por uma ponte de enxofre. Os tipos de cadeias variam de acordo com a população de linfócitos T. O TCR dos linfócitos intraepiteliais, conhecidos como Linfócitos γδ, é formado por uma cadeia gama e outra delta, daí o nome que receberam. Voltaremos a falar sobre esses linfócitos em seções futuras. Já o TCR dos linfócitos T auxiliares CD4+ e T citotóxicos CD8+, estudados na última seção, é formado por uma cadeia alfa e uma cadeia beta. Cada cadeia pode ser subdividida em duas regiões: a variável, localizada na porção N-terminal, e a constante, que termina em uma pequena cauda intracelular, na porção C-terminal. Essa divisão é importante, pois as regiões possuem funções distintas. Enquanto a região constante fixa a cadeia na membrana plasmática, a região variável é responsável pelo reconhecimento antigênico. Essa região possui pequenas sequências de aminoácidos, chamadas de regiões determinantes de complementariedade (CDR), que funcionam como ganchos para interação com epítopos antigênicos. Consideradas regiões hipervariáveis, é ali que de fato se concentram as diferenças entre os TCRs de um indivíduo. Existem três CDRs na cadeia alfa e três na cadeia beta. Juntas, essas regiões determinam a especificidade de cada receptor.
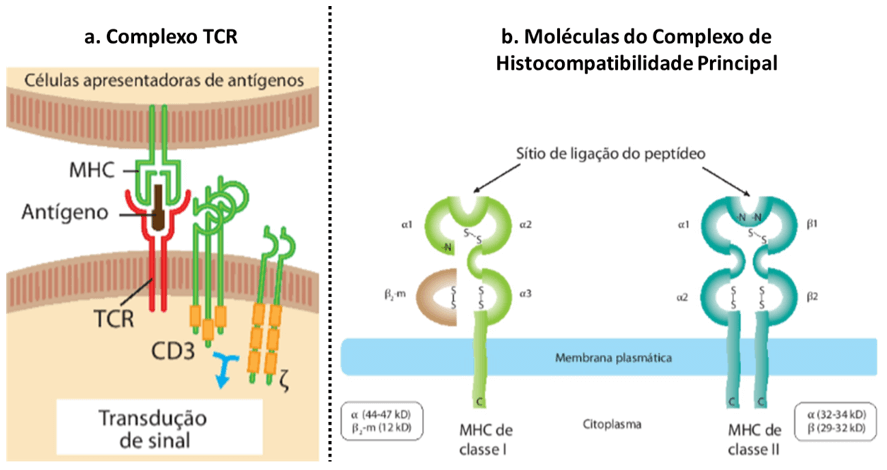
Como as caudas citoplasmáticas das cadeias alfa e beta são muito curtas para fazerem a transdução de sinal após a ligação com o antígeno, outras moléculas auxiliam nesse quesito. As proteínas CD3 e zeta (ζ) estão associadas de forma não covalente ao TCR, formando o complexo TCR. Quando o TCR reconhece o antígeno, essas proteínas sofrem uma mudança conformacional e transduzem o sinal que inicia a ativação (ou função efetora) do linfócito T. É importante destacar que as proteínas CD3 e ζ são idênticas em todos os linfócitos T, independentemente da diferença na especificidade dos seus TCRs. Para auxiliá-lo na visualização de todo o complexo, veja a Figura 1.1. Se ainda ficou difícil de entender, aí vai uma dica: imagine o TCR como sendo um aparelho de telefone, daqueles antigos, e as cadeias CD3 e ζ, o fio que conduz a ligação.
Assimile
Um único indivíduo pode apresentar entre 105 e 106 linfócitos T diferentes, cada qual com uma especificidade única. Para garantir tamanha diversidade, com um número limitado de genes, foi necessário desenvolver um complexo mecanismo de recombinação de DNA. Como já mencionamos, a porção variável dos TCRs é o que difere entre os receptores. Para codificá-la, existem 3 regiões no genoma: a V (variável), a D (diversidade) e a J (junção). Cada região contém diferentes segmentos gênicos. Durante a maturação, o DNA dos linfócitos é recombinado, de modo que apenas um segmento de cada região permanece na célula. Os demais são descartados. A porção variável do TCR será, portanto, resultado dos segmentos remanescentes. Como a escolha do segmento de cada região é aleatória, inúmeras combinações V(D)J diferentes surgem a partir desse processo. Além disso, mutações pontuais que ocorrem nesses segmentos contribuem na geração de um repertório de TCRs extremamente diverso. O mesmo processo também garante a geração dos BCRs, durante a maturação dos linfócitos B.
Você deve estar se perguntando: como os TCRs interagem com os antígenos? Para responder a essa pergunta precisamos lembrar que a função da maioria dos linfócitos T requer a interação com outras células, seja para receber sinais ativadores, seja para auxiliá-las ou eliminá-las, no caso de estarem infectadas. A fim de assegurar que os linfócitos T interajam com células e não com o antígeno solúvel, os TCRs são capazes de reconhecer o antígeno apenas quando ligado às proteínas do complexo de histocompatibilidade principal (MHC).
Existem dois tipos de moléculas de MHC, as de classe I e as de classe II. Ambos são produtos de genes altamente polimórficos, expressos de maneira codominante.
Dica
Polimorfismo, de acordo com Griffiths e colaboradores (2008, p. 58), designa a ocorrência em uma população de várias formas fenotípicas associadas a alelos de um gene ou homólogos de um cromossomo. Ou seja, se pensarmos no gene como a receita para uma proteína e no alelo como uma versão dessa receita, um gene polimórfico seria uma receita com várias versões diferentes. Para entender a palavra codominância precisamos lembrar que um indivíduo é formado por duas versões de cada gene, recebidas do pai e da mãe biológicos. Se as versões forem diferentes, o indivíduo é considerado heterozigoto para aquele gene e, na maioria das vezes, apenas uma das versões é expressa. No caso de genes codominantes, ambas as versões, materna e paterna, são expressas no indivíduo.
Em nós, seres humanos, os genes do MHC estão localizados no braço curto do cromossomo 6 e são chamados de antígenos leucocitários humanos (HLA). Existem 3 genes de classe I, HLA-A, -B e -C, além de 3 genes de classe II, HLA-DP, -DQ e -DR, cada qual codificando uma proteína de mesmo nome.
Atenção
Cada gene do complexo MHC possui um número variável de alelos. Dessa forma, podemos dizer que existem inúmeras versões do gene (as inúmeras versões do gene B e assim por diante). Como um indivíduo recebe apenas uma versão de cada gene parental, ele expressa apenas duas dentre as inúmeras versões existentes para cada tipo.
Apesar de compartilharem certas características, as moléculas de classe I e II diferem quanto à sua estrutura bioquímica, às células onde são expressas e à fonte dos antígenos que apresentam, bem como quanto aos linfócitos para os quais esses antígenos serão apresentados. Veja novamente a Figura 1.1.
As moléculas de HLA classe I são formadas por uma cadeia alfa, variável entre os diferentes tipos, e uma cadeia invariável, chamada de β2-microglobulina. A região extracelular da cadeia alfa forma uma estrutura em formato de fenda onde o peptídeo antigênico se liga, chamada de fenda de ligação do peptídeo. A fenda é o local de maior variabilidade na sequência de aminoácidos codificada pelos diferentes alelos e nela só podem se ligar antígenos proteicos. Cada molécula de MHC é capaz de ligar e apresentar um conjunto de peptídeos diferentes, que vão sendo mostrados um por vez. Como essa ligação depende de interações não covalentes, todos os peptídeos antigênicos que são apresentados por uma mesma molécula precisam compartilhar entre si semelhanças bioquímicas, como cargas iguais nas mesmas posições, por exemplo. As moléculas de classe I são encontradas em praticamente todas as células nucleadas e apresentam antígenos aos linfócitos T CD8+. A princípio, qualquer célula nucleada pode ser infectada por um patógeno intracelular ou se tornar tumoral. Assim, proteínas microbianas ou tumorais, encontradas no citoplasma das células-alvo, são ligadas a moléculas de classe I e mostradas aos linfócitos T citotóxicos, que podem exercer sua função efetora apenas contra essas células. Como a maioria dos indivíduos são heterozigotos para os genes do MHC, uma única célula nucleada pode apresentar até 6 moléculas de classe I diferentes.
Já as moléculas de HLA classe II são formadas por duas cadeias variáveis, a cadeia alfa e a cadeia beta. A fenda de ligação do peptídeo é formada pelas regiões extracelulares de ambas as cadeias e, da mesma forma como vimos para as moléculas de classe I, essas regiões são de extensa variabilidade, capazes de acomodar um conjunto de peptídeos diferentes.
Atenção
Apesar de receberem o mesmo nome, as cadeias alfa e beta que formam TCRs são diferentes.
Aqui também o padrão de expressão das moléculas de classe II está relacionado à função dos linfócitos para os quais os antígenos são mostrados. Os linfócitos T CD4+ auxiliam células imunes a melhorarem suas funções efetoras. Para receberem esse auxílio, elas precisam provar que estão reagindo contra algo estranho ao organismo. E o fazem, mostrando aos linfócitos T, via moléculas de classe II, peptídeos gerados pela proteólise de antígenos fagocitados ou endocitados. Um indivíduo heterozigoto pode apresentar mais de oito moléculas de HLA de classe II diferentes em uma APC, uma vez que as cadeias alfa e beta, localizadas nos cromossomos homólogos, podem se combinar, aumentando a diversidade de moléculas existentes.
Atenção
Não deixe de notar que, quanto mais diverso for o conjunto de alelos de MHC expresso por um indivíduo, maior será o repertório de antígenos para os quais ele responderá.
Reflita
Você provavelmente já ouviu dizer que cachorros vira-latas são muito mais resistentes a infecções do que cachorros de raça definida. Você saberia correlacionar esse fato ao que acabamos de estudar?
É importante destacar que o sinal iniciado a partir do reconhecimento do complexo MHC-peptídeo pelo TCR é apenas o primeiro dos três sinais necessários para a ativação do linfócito T. A ligação de moléculas coestimuladoras entre o linfócito e a APC, além da produção de citocinas no momento desse contato (e em decorrência do ambiente inflamatório iniciado na resposta inata), completam os requisitos. Esses sinais também serão necessários para a realização das funções efetoras, especialmente no caso dos linfócitos auxiliares.
Então, voltando à pergunta inicial, o que torna um antígeno um imunógeno para os linfócitos T? A resposta é: ser apresentado pelo MHC do indivíduo e ter um ambiente inflamatório que estimule os sinais necessários para complementar o reconhecimento inicial.
Assimile
De acordo com o fenômeno de restrição ao MHC próprio, o linfócito T só é capaz de reconhecer determinado antígeno caso seja apresentado por uma molécula de MHC (classe I ou II) proveniente do mesmo indivíduo. O mesmo antígeno, quando apresentado por uma molécula de MHC não própria, não será reconhecido.
E para os linfócitos B, o que seria um antígeno imunogênico? Para responder a essa pergunta precisamos nos voltar para os anticorpos, glicoproteínas sintetizadas por linfócitos B, também conhecidas como imunoglobulinas (Ig). Os anticorpos podem ser encontrados em duas formas principais: 1. Fixados na membrana plasmática desses linfócitos, onde funcionam como o receptor para antígenos (BCR); ou 2. Na forma solúvel, encontrados em diversos tecidos do organismo.
Vale ressaltar que o BCR também forma um complexo sinalizador (complexo BCR) com outras três moléculas: as imunoglobulinas, a alfa e a beta, e o CD19, responsáveis pela transdução do sinal após a ligação do receptor com o antígeno cognato (Figura 1.2). A ativação desse linfócito requer ainda um segundo sinal dado pelo reconhecimento de um PAMP ou fragmento de moléculas do sistema complemento que estejam opsonizando o patógeno em questão.
Todos os anticorpos compartilham uma estrutura básica (Figura 1.2) composta por duas cadeias de maior tamanho, idênticas entre si, chamadas de cadeias pesadas, e duas cadeias menores, chamadas de cadeias leves, também idênticas, ligadas por pontes de enxofre.
As cadeias leves e pesadas podem ser divididas nas regiões variável e constante. A primeira é responsável pelo reconhecimento antigênico, enquanto a segunda está relacionada à função efetora da molécula. Se você se lembrou dos TCRs e do MHC, parabéns! A estrutura dos receptores adaptativos é realmente muito parecida.
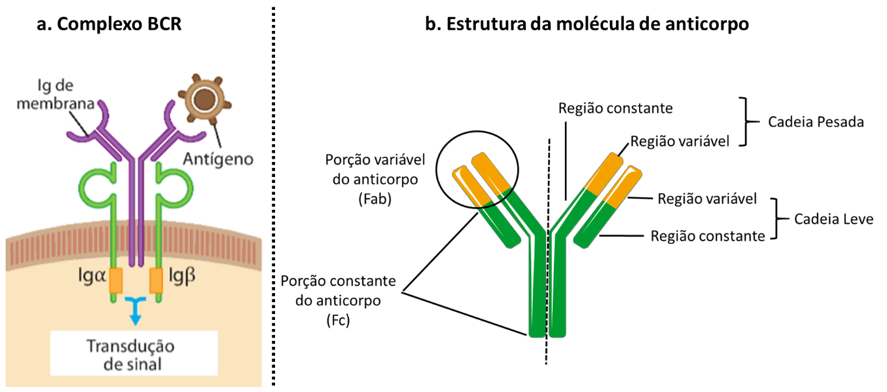
Vamos olhar primeiramente para a região variável. Conforme já falamos, cada linfócito B produz um BCR (portanto, um anticorpo) com especificidade única. A diversidade de receptores é resultado da grande variabilidade de sequências encontradas na região variável das cadeias leve e pesada. Aqui também encontramos as regiões determinantes de variabilidade (CDRs). Existem três CDRs na cadeia leve e três na cadeia pesada. Juntas, essas regiões hipervariáveis formam o sítio de interação com o antígeno e determinam a especificidade de cada anticorpo, conforme mostra a Figura 1.2.
A conformação tridimensional do sítio de interação com o antígeno permite que o anticorpo reconheça antígenos de diferentes tamanhos e origens bioquímicas. Esse reconhecimento é baseado em interações não covalentes entre ambas as moléculas, tais como interações eletrostáticas, hidrofóbicas, pontes de hidrogênio e força de van der Waals. A importância relativa de cada uma depende justamente das CDRs do sítio presente em cada anticorpo e do epítopo antigênico. Quanto maior a quantidade de interações ocorridas, maior será a afinidade do anticorpo pelo antígeno e mais difícil será desligá-los.
Alguns antígenos, em especial macromoléculas como carboidratos, podem apresentar epítopos que se repetem ao longo de sua estrutura. Nesses casos, dizemos que são multi ou polivalentes. Devido à simetria bilateral e à flexibilidade conferida pelas pontes de enxofre que ligam suas cadeias, um único anticorpo pode interagir com o antígeno multivalente em mais de um ponto. Nesses casos, a força de ligação entre o antígeno e o anticorpo deve levar em consideração a soma de todos os pontos de interação possíveis entre essas moléculas, ou seja, a avidez do anticorpo pelo antígeno. Muitas vezes, anticorpos com baixa afinidade pelo epítopo apresentam uma alta avidez pelo antígeno multivalente. Fique atento, pois as interações polivalentes entre antígenos e anticorpos possuem uma enorme significância biológica, visto que os anticorpos desencadeiam melhor sua função efetora quando são aproximados por se ligarem ao mesmo tempo em antígenos multivalentes.
Vamos olhar agora para a região constante das cadeias que formam o anticorpo, pois ela determina o tipo de cadeia leve e pesada que forma a molécula. Existem dois tipos de cadeias leves, a kappa (ƙ) e a lambda (λ), codificadas por genes de mesmo nome. A escolha entre os dois tipos de cadeia leve acontece durante o processo de maturação do linfócito B que produzirá o anticorpo em questão. Para a região constante da cadeia pesada existe uma gama maior de tipos de cadeias possíveis, frutos de pelo menos 8 genes diferentes: micra (µ), alfa (α), gama (γ1, γ2, γ3 e γ4), épsilon (ε) e delta (δ). Cada gene codifica um tipo de cadeia pesada que não apenas dá nome ao anticorpo (IgM, IgA, IgG1, IgG2, IgG3, IgG4, IgE e IgD, respectivamente) como também define sua função efetora e dita certas características bioquímicas como solubilidade, por exemplo.
A maior parte dos BCRs de um linfócito B não ativado é do tipo IgM. Após a sua ativação pelo antígeno, essa célula passa a secretar a forma solúvel do anticorpo. Eventualmente, dependendo do antígeno e do padrão de resposta imune em andamento, o linfócito faz o que chamamos de mudança de isotipo, processo em que deixa de expressar o gene micra e passa a expressar algum outro (α, γ1, γ2, γ3, γ4 ou ε), resultando na troca do tipo de anticorpo secretado. Note que a especificidade do anticorpo é mantida, ou seja, o epítopo reconhecido pelo anticorpo original permanece o mesmo. Se você está se perguntando o motivo dessa troca, lembre-se de que a porção constante da molécula está relacionada à sua função efetora. Logo, mudando o tipo de cadeia, ajustamos o anticorpo para a função efetora mais necessária à resposta em andamento.
E quais são as funções efetoras dos anticorpos? Anticorpos podem inibir, ou neutralizar, a infeção de células por patógenos intracelulares ao se ligarem a antígenos necessários para a invasão da célula-alvo. Essa ação neutralizante também é importante contra toxinas. Anticorpos IgG e IgA são os mais eficientes nessa função. Fagócitos possuem receptores para a porção constante dos anticorpos. Dessa forma, microrganismos recobertos com anticorpos (opsonizados), especialmente IgG, são internalizados e digeridos mais facilmente por essas células. Alguns subtipos de IgG são excelentes indutores da citotoxicidade dependente de anticorpo, em que células NK e outros leucócitos induzem a apoptose de células recobertas por esses anticorpos. Anticorpos IgE ligados à superfície de helmintos auxiliam na degranulação de eosinófilos e mastócitos, fato importante para a eliminação do parasita. Finalmente, anticorpos IgM são muito eficientes na ativação da via clássica do complemento. Perceba que, com exceção da função neutralizante, as demais funções dos anticorpos são baseadas na melhoria de mecanismos inatos. É como se os anticorpos conferissem às células inatas a especificidade fina característica da resposta adaptativa.
E como o linfócito B sabe qual tipo de anticorpo ele deve produzir? A resposta está no auxílio dado pelo linfócito T CD4+. Após o reconhecimento do antígeno, o linfócito B o internaliza e faz sua digestão. Peptídeos gerados pela quebra de proteínas antigênicas podem ser expostos em moléculas de MHC de classe II na membrana do linfócito B. O reconhecimento do complexo peptídeo-MHC por um linfócito T CD4+ efetor inicia o processo de comunicação entre ambas as células. Aqui, vale a pena destacar dois pontos. O primeiro é a ligação entre as moléculas coestimuladoras CD40, expressa pelo linfócito B, e CD40L, expressa pelo linfócito T. Os resultados dessa interação são a indução da proliferação dos linfócitos B, a ativação do mecanismo responsável pela mudança de isotipo, melhorias na afinidade do anticorpo produzido, a diferenciação em plasmócitos e a geração de linfócitos B de memória. O segundo ponto refere-se às citocinas que o linfócito T produz no momento dessa interação, pois são elas que influenciarão o tipo de anticorpo que passará a ser secretado após a troca de isotipo. Dessa forma, podemos concluir que os diferentes subtipos de células T CD4+ (Th1, Th2 e Th17) induzirão a produção de isotipos diferentes. Vale ressaltar que, para responder a antígenos não proteicos, o linfócito B não precisa do auxílio do linfócito T. Por esse motivo, a resposta contra os chamados antígenos T-independentes é marcada pela produção apenas de IgM e não há diferenciação em célula B de memória.
Exemplificando
Os anticorpos são, atualmente, ferramentas imprescindíveis na prática clínica, usados desde o imunodiagnóstico até em terapias para tratamento de inúmeras doenças. Contudo, sua utilização só foi possível após a técnica descrita por Georges Kohler e Cesar Milstein em 1975: a produção de anticorpos monoclonais. Ao observar que plasmócitos tumorais provinham de uma única célula, sendo, portanto, monoclonais, e que produziam anticorpos com especificidade única, os pesquisadores desenvolveram uma forma de imortalizar linfócitos B que produziam anticorpos contra um antígeno de interesse. A técnica hoje se baseia na imunização de um camundongo com um determinado antígeno. Após alguns dias, células B esplênicas são separadas e, in vitro, fundidas com células de uma linhagem de mieloma (um tumor de plasmócitos) utilizando-se um composto químico como o polietilenoglicol. Vale ressaltar que, diferentemente dos linfócitos B, as células de mieloma não produzem anticorpos próprios e nem possuem a enzima hipoxantina-fosforribosil transferase (HPRT), responsável pela produção de purinas, bases nitrogenadas que compõem o DNA.
A partir da fusão, três combinações podem ocorrer: 1. Linfócito B e linfócito B; 2. Mieloma e mieloma; ou 3. Linfócito B e mieloma. As células resultantes da primeira combinação irão morrer após alguns dias. No entanto, as combinações 2 e 3 são imortais. Entre ambas, apenas a célula híbrida, formada pela fusão entre um linfócito B e um mieloma, interessa. Para obtê-las, as células são cultivadas no meio de cultura seletivo HAT (hipoxantina, aminopterina e timidina). Nesse meio de cultura, as células que são deficientes para a enzima HPRT não conseguem se dividir. Logo, apenas as células resultantes da combinação entre um linfócito B e um mieloma sobrevivem e passam a ser chamadas de hibridomas. Cada hibridoma produz apenas um anticorpo, derivado do linfócito B do animal imunizado. O conjunto de todos os hibridomas formados no processo produz um pool de anticorpos conhecido como anticorpos policlonais. Se um hibridoma do conjunto for isolado e expandido, o anticorpo produzido por ele será específico apenas para um epítopo do antígeno e, como terá vindo de um único clone inicial, será chamado de anticorpo monoclonal.
Ao terminar esta seção, você completou toda a base necessária para avançarmos no entendimento da imunologia clínica. Vamos seguir em frente?
Faça valer a pena
Questão 1
Os anticorpos são considerados as moléculas efetoras da resposta adaptativa humoral. Correspondem a glicoproteínas produzidas por linfócitos B, sendo encontradas em duas formas: ou fixadas na membrana plasmática dessas células, onde funcionam como receptores, ou secretadas por linfócitos B ativados.
Sobre a estrutura básica dos anticorpos, assinale a alternativa correta:
Correto!
A opção “e” está errada, pois os anticorpos são formados por duas cadeias pesadas e duas cadeias leves idênticas entre si. As demais opções estão incorretas, visto que cada cadeia pode ser dividida nas regiões variável e constante. As regiões variáveis das cadeias pesada e leve formam, juntas, a porção Fab, responsável por reconhecer o antígeno. Já as regiões constantes de ambas as cadeias pesadas formam a porção Fc, responsável não apenas pelo nome conferido a cada tipo de anticorpo, mas também por sua função efetora e características bioquímicas.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Questão 2
As moléculas do complexo principal de histocompatibilidade (MHC) são produtos de genes altamente polimórficos e expressos de maneira codominante. Sua principal função é apresentar antígenos ao linfócito T, levando à sua ativação ou permitindo que exerça sua ação efetora.
Acerca do complexo de histocompatibilidade principal (MHC), é correto afirmar que:
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Correto!
As moléculas de MHC são responsáveis por apresentar os antígenos para os linfócitos T, que são incapazes de reconhecê-los na forma solúvel. As opções “a” e “b” estão trocadas, visto que moléculas de MHC de classe I são expressas por células nucleadas e apresentam peptídeos citosólicos para os linfócitos T CD8+. Por sua vez, as de classe II são responsáveis por mostrar antígenos derivados da digestão de antígenos fagocitados ou endocitados. Sua expressão é limitada a células do sistema imune e algumas células epiteliais, razão pela qual a opção “d” está incorreta. Em comum, tanto as moléculas de classe I quanto as de classe II possuem uma fenda de ligação do peptídeo na porção extracelular, local onde o epítopo antigênico se liga. A opção “e” é incorreta, pois uma mesma molécula de HLA é capaz de ligar um conjunto de diferentes epítopos, um por vez. Este fato determina o repertório de antígenos aos quais um indivíduo é capaz de responder.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Questão 3
O linfócito T CD4+ auxiliar pode ser considerado o orquestrador da resposta imune adaptativa, visto que o perfil de produção de citocinas por ele assumido durante a resposta influencia a forma de atuação das demais células envolvidas. Para que isso ocorra, no entanto, é necessário que o linfócito T CD4+ reconheça o seu antígeno cognado apresentado via molécula de MHC de classe II.
Com base nos seus conhecimentos sobre o complexo de histocompatibilidade principal e os requisitos necessários para a ativação da resposta imune, avalie as seguintes asserções e a relação proposta entre elas:
I. Apesar do vasto repertório de linfócitos T CD4+ existentes, um indivíduo pode ser incapaz de responder de forma eficiente a determinado antígeno.
PORQUE
II. A fenda de ligação do peptídeo presente na molécula de MHC é capaz de se ligar a um conjunto limitado de peptídeos diferentes.
Assinale a alternativa correta acerca das asserções apresentadas.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Correto!
Os linfócitos T CD4+ são capazes de responder contra um determinado antígeno apenas quando apresentado por uma molécula de MHC de classe II. Devemos lembrar ainda que uma mesma molécula de MHC é capaz de ligar um conjunto de diferentes epítopos, um por vez. Assim, quanto mais diversas forem as moléculas de classe II expressas por um indivíduo, maior será o repertório de antígenos que poderão ser mostrados aos seus linfócitos. O inverso também é verdade. Quando a variedade de moléculas de MHC expressas por um indivíduo for menor, um conjunto menor de epítopos será mostrado aos seus linfócitos. Ou seja, mesmo que o indivíduo apresente linfócitos específicos para o antígeno, sem uma molécula de MHC que consiga mostrá-lo eles não serão ativados. Portanto, ambas as assertivas estão corretas e a II justifica a I.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Referências
ABBAS, A. K.; LICHTMAN, A. H.; PILLAI, S. Imunologia Celular e Molecular. 8. ed. Rio de Janeiro: Guanabara Koogan, 2015.
ABBAS, A. K.; LICHTMAN, A. H.; PILLAI, S. Imunologia Celular e Molecular. 5. ed. Rio de Janeiro: Guanabara Koogan. 2005.
GOLDBERG, A. C.; RIZZO, L. V. Estrutura do MHC e função – apresentação de antígenos. Parte 1. Einstein (São Paulo), v. 13, n. 1, 2015. Disponível em: https://bit.ly/35aLZaB. Acesso em: 30 jan. 2021.
GOLDBERG, A. C.; RIZZO, L. V. Estrutura do MHC e função – apresentação de antígenos. Parte 2. Einstein (São Paulo), v. 13, n. 1, 2015. Disponível em: https://bit.ly/3xn7PnJ. Acesso em: 30 jan. 2021.
GRIFFITHS, A. J. F.; WESSLER, S. R.; LEWONTIN, R. C.; CARROL, S. B. Introdução à Genética. 9. ed. Rio de Janeiro: Guanabara Koogan, 2009.
PARSLOW, T. G.; STITES, D. P.; TERR, A. I.; IMBODEN, J. B. Imunologia Médica. 10. ed. Rio de Janeiro: Guanabara Koogan, 2004.
PLAYFAIR, J. H. L.; CHAIN, B. M. Imunologia Básica: guia ilustrado de conceitos fundamentais. 9. ed. São Paulo: Manole, 2013.
SANTOS, M. L., QUINTILIO, W., MANIERI, T. M., TSURUTA, L.R., MORO, A. M.. Advances and challenges in therapeutic monoclonal antibodies drug development. Braz. J. Pharm. Sci., v. 54, 2018.
SANTOS, R. V., LIMA, P. M., NITSCHE, A., HARTH, F. M., MELO, F. Y., AKAMATSU, H. T., LIMA, H. C. Aplicações terapêuticas dos anticorpos monoclonais. Rev. Bras. Alerg. Imunopatol., v. 29, n. 2, 2002.
SCUTTI, J. A. B. Fundamentos da Imunologia. 1. ed. São Paulo: Editora Rideel. 2016.Disponível em: https://bit.ly/3g3UN8K. Acesso em: 11 fev. 2021.



