.jpg)
Fonte: Shutterstock.
Deseja ouvir este material?
Áudio disponível no material digital.
Praticar para aprender
Até o início do século XX a expectativa de vida da população mundial girava em torno dos 40 anos. As principais causas de óbitos se deviam principalmente à falta de saneamento básico e às infecções decorrentes de questões sanitárias. Na virada do século, com as melhorias de saneamento básico e o advento das vacinas, a expectativa de vida da população aumentou para a faixa entre 70 e 80 anos. O envelhecimento da população, no entanto, elevou o número de óbitos relacionados às doenças crônico-degenerativas, tais como doenças cardiovasculares, doenças neurológicas, como o Mal de Alzheimer, e os tumores.
De acordo com dados da Organização Mundial da Saúde (2019), os tumores estão entre as duas primeiras causas de morte antes dos 70 anos em 112 países do mundo. E, segundo Sung et al. (2021), as estimativas para 2020 eram de 19,3 milhões de novos casos e cerca de 10 milhões de mortes por tumores. Em 2040, os números praticamente aumentarão em quase 50%. São esperados 28,4 milhões de novos casos, ainda que não se saiba o impacto da pandemia de COVID-19 nesses números. Embora o envelhecimento da população seja um fator proeminente nesse aumento, o crescimento populacional e o desenvolvimento socioeconômico também influenciam no número e no tipo de tumores predominantes em cada país. Um exemplo é o número ainda expressivo de tumores associados a infecções nos países em desenvolvimento, enquanto se observam números mais elevados de tumores associados a hábitos urbanos, como o sedentarismo, o consumo de alimentos industrializados e a poluição nos países desenvolvidos.
Todos esses dados destacam o tumor como um dos maiores problemas de saúde pública a ser enfrentado. Por causa da importância para seu futuro profissional, abordaremos nesta seção como nosso sistema imune reage frente a um tumor: quais os antígenos tumorais que estimulam o sistema imune, as formas como os tumores evadem o sistema de defesa e, finalmente, como a manipulação do sistema pode favorecer o tratamento de pacientes com câncer.
Para contextualizar sua aprendizagem, vamos retomar a situação-problema da primeira seção, na qual você, já formado, acabou de passar para o programa de mestrado em Imunologia Clínica. Ao chegar no laboratório onde desenvolverá sua tese, sua orientadora sugeriu que conversasse com os demais alunos para conhecer melhor as linhas de pesquisa desenvolvidas ali. A terceira aluna com a qual você conversou foi a Ana Paula, responsável por um projeto sobre a resposta imune contra tumores.
Para obter alguns dados relacionados aos mecanismos imunológicos antitumorais, a Ana Paula repetiu um dos experimentos clássicos relacionados a esse tema. No experimento, duas linhagens de camundongos, uma imunocompetente e outra imunossuprimida, foram tratadas com carcinógenos químicos para o desenvolvimento de um tumor. Após o crescimento da massa tumoral, os tumores foram transplantados em outros camundongos imunocompentes, iguais aos da primeira fase. O resultado que ela obteve foi o esperado: o tumor derivado do camundongo imunocompetente cresceu no novo hospedeiro, enquanto o tumor derivado do camundongo imunossuprimido, foi eliminado pelo hospedeiro que o recebeu. Ana Paula pediu então que você explicasse esses resultados. O que você diria a ela?
Começa agora um novo capítulo extremamente importante para o seu futuro profissional! Vamos juntos?
conceito-chave
O câncer é um dos maiores problemas de saúde pública no mundo e uma das mais importantes causas de morbidade e mortalidade entre adultos e crianças. Trata-se de um conjunto extremamente diverso de doenças que resulta de eventos genéticos herdados ou adquiridos tais como mutações, deleções, duplicações, translocações cromossômicas e descontroles epigenéticos, os quais, por sua vez, culminam em mudanças na biologia da célula. A célula alterada passa a proliferar mais ou “morrer menos” do que deveria. A aquisição de uma ou de ambas as características favorecem o aparecimento de novas alterações genéticas que podem levar a alterações malignas da célula alterada.
Assimile
Antes de continuarmos, é preciso definir alguns conceitos para que não haja confusão.
A palavra tumor corresponde ao aumento no volume de qualquer tecido do corpo. Quando a causa desse aumento é o crescimento anômalo no número de células que compõem um dado tecido, damos o nome de neoplasia, a qual pode ser benigna ou maligna, a depender do comportamento das células.
Nas neoplasias benignas, as células crescem de forma organizada, normalmente lenta, com os limites da massa neoplásica bem definidos. Já as neoplasias malignas são caracterizadas por uma alta taxa de proliferação celular, pelo crescimento desorganizado e por possuírem a capacidade de fazer metástase, ou seja, de sair do tecido de origem e se estabelecer em outro. Câncer é o nome dado às neoplasias malignas.
Em 2000, dois pesquisadores, Douglas Hanahan e Robert Weinberg, elencaram seis alterações na fisiologia das células que, juntas, ditam o crescimento maligno:
1. Autossuficiência dos fatores de crescimento.
2. Insensibilidade a sinais inibidores do crescimento.
3. Evasão da apoptose.
4. Potencial replicativo ilimitado (imortalidade).
5. Capacidade de gerar novos vasos sanguíneos (angiogênese sustentada).
6. Invasão de tecidos e metástase.
Essas características ficaram mundialmente conhecidas como os “hallmarks do câncer”.
É importante entender que elas não aparecem ao mesmo tempo em uma única célula. Na verdade, vão sendo adquiridas gradualmente, à medida que novas mutações vão surgindo. Isso nos leva a um fato que já era conhecido na época em que os hallmarks foram descritos: a heterogeneidade genotípica e, principalmente, fenotípica das células que compõem a massa tumoral. Como as mutações no DNA são aleatórias, cada célula da massa pode apresentar características distintas que as divide em subpopulações com potenciais replicativos e de sobrevivência diferentes. Ou seja, algumas subpopulações podem ter maior potencial metastático, ser mais resistentes à quimioterapia ou, ainda, ser menos imunogênicas.
Além da heterogeneidade celular, o microambiente onde o tumor se encontra passou a ser visto com maior interesse devido à sua contribuição para a evolução tumoral e à manifestação clínica do câncer. Esse nicho é composto por células não malignas, residentes do próprio tecido, como fibroblastos e células endoteliais, e células atraídas para esse local em resposta a fatores solúveis, a moléculas da matriz extracelular ou a condições ambientais como hipóxia ou pH ácido, produzidos ou induzidos pelo tumor. Assim, compondo o microambiente, também temos células do sistema imune, células supressoras de origem mieloide, entre outras. A complexidade do microambiente tumoral é tamanha que atualmente o tumor é considerado um novo órgão.
As novas descobertas e esse novo olhar sobre o comportamento das células tumorais e sobre o ambiente onde estão inseridas levaram Hanahan e Weinberg (2011) a adicionar mais quatro hallmarks à lista feita por eles anteriormente. São eles:
7. Inflamação promovida pelo tumor.
8. Instabilidade genômica e aquisição de novas mutações.
9. Desregulação no metabolismo energético.
10. Capacidade de evadir o sistema imunológico.
A relação entre o sistema imune e os tumores já era conhecida no final do século XIX e foi explorada na época pelo médico cirurgião Willian B. Coley. Ele havia percebido que pacientes com tumores e que também apresentavam infecções passavam por uma regressão tumoral, provavelmente desencadeada pela resposta de defesa contra a infecção. Coley passou então a injetar extrato de bactérias, conhecido como “toxinas de Coley”, nos seus pacientes que sofriam com tumores agressivos e encontrou uma boa resposta em grande parte deles.
No entanto, a possibilidade de que tumores podem ser erradicados por respostas imunes específicas surgiu de uma hipótese desenvolvida pelo médico americano Lewis Thomas na década de 1950. Alguns anos mais tarde, a hipótese foi ampliada por Macfarlane Burnet, quem dizia que a função fisiológica do sistema imune é reconhecer e destruir clones de células transformadas antes que dessem origem a tumores ou, no caso de tumores já estabelecidos, eliminá-los. Essa é a base do conceito de imunovigilância desenvolvido por ele.
Nos anos seguintes, diversas evidências confirmaram a importância da vigilância imunológica na prevenção do crescimento tumoral. Os indivíduos imunossuprimidos, por exemplo, apresentam maior incidência de certos tipos de tumores do que indivíduos imunocompetentes. O transplante de tumores entre animais singeneicos (geneticamente idênticos) são rejeitados mais rapidamente se os receptores também tiverem recebido linfócitos provenientes do animal do qual o tumor foi extraído, mostrando que a rejeição tumoral depende dessas células e apresenta características da resposta adaptativa como especificidade e memória.
De fato, a resposta imune antitumoral se baseia nos mesmos mecanismos acionados contra os patógenos intracelulares. A imunidade inata é ativada por meio da quebra da fisiologia normal do tecido pelo crescimento das células transformadas e pela formação do microambiente já mencionado. Lembre-se de que existem receptores de reconhecimento padrão (PRRs) responsáveis pelo reconhecimento de moléculas associadas ao perigo (DAMPs), liberadas por estresse ou morte celular. Uma das células que parecem contribuir para a imunovigilância inata são as Natural Killers (NK). Elas possuem um papel proeminente no controle de malignidades hematológicas como diversas formas de leucemias e linfomas e, embora sua atuação contra tumores sólidos ainda não tenha sido totalmente esclarecida, in vitro já demonstrou ser capaz de eliminar diferentes linhagens tumorais. Além disso, são capazes de promover a citotoxicidade dependente de anticorpo (ADCC) quando há anticorpos do tipo IgG recobrindo a célula tumoral. Finalmente, macrófagos, diferenciados no perfil M1, são capazes de eliminar as células tumorais por meio da fagocitose. No entanto, a maior contribuição inata é o estabelecimento de um ambiente inflamatório propício para a ativação da imunidade adaptativa.
A resposta adaptativa se inicia com a ativação das células dendríticas, que ingerem as células tumorais ou seus antígenos, e faz a apresentação de peptídeos derivados da digestão desse conteúdo em moléculas de MHC de classe II. Como essas células também possuem MHC de classe I, alguns peptídeos tumorais são apresentados via tais moléculas por um processo conhecido como apresentação cruzada. Assim, as células dendríticas provenientes do tecido de origem do tumor, migram para os linfonodos drenantes e ativam tanto linfócitos TCD4+ quanto TCD8+. O perfil de resposta que predomina é o Th1, especialmente observado nos pacientes que apresentam melhor prognóstico. Já os linfócitos TCD8+ se diferenciam em células citotóxicas e representam o principal mecanismo adaptativo na morte tumoral. Tal como todas as células nucleadas, as tumorais também expressam MHC de classe I, possibilitando seu reconhecimento por linfócitos citotóxicos tumor-específicos. Os linfócitos B participam da resposta antitumoral, especialmente contra tumores iniciados por patógenos oncogênicos, como o vírus Epstein-Barr, produzindo anticorpos capazes de fixar complemento ou induzir a morte da célula tumoral via ADCC.
Ao longo das outras seções, falamos exaustivamente que o sistema imune atua apenas contra os alvos que enxerga. Sabendo que os tumores surgem de tecidos do próprio organismo, quais são os antígenos capazes de deflagrar a resposta imunológica? Bem, existem vários tipos de antígenos tumorais, que podem ser divididos em dois grandes grupos: antígenos tumor-específicos, únicos das células tumorais, e antígenos associados ao tumor, compartilhados entre as células tumorais e células normais. Agrupados em um ou em outro grupo, podemos destacar as diferentes classes de antígenos.
Os neoantígenos recebem esse nome, pois são produtos de genes mutados aleatoriamente, presentes apenas nas células tumorais e não nas células saudáveis do tecido onde o tumor se originou.
Exemplificando
Para compreender melhor de onde surgem os neoantígenos, é necessário destacar que existem dois tipos principais de mutação na célula tumoral. As mutações condutoras (drive mutations) são alterações no DNA que resultam na aquisição dos hallmarks do câncer, mencionados anteriormente. Ou seja, são mutações cujos produtos estão relacionados à transformação maligna das células ou à manutenção do fenótipo maligno.
Já as mutações passageiras (passengers mutations) acontecem em diversos genes não relacionados ao processo de transformação tumoral e são reflexo da instabilidade genômica das células malignas. Os neoantígenos são produtos dessas mutações passageiras e, por serem muito imunogênicos, visto que são estranhos ao sistema imune, representam os alvos mais comuns nas respostas tumor-específicas. De fato, o número dessas mutações em diversos cânceres humanos está correlacionado à força da resposta antitumoral observada no paciente.
Outro grupo de antígenos tumorais são os produtos de oncogênese ou de genes supressores tumorais mutados, derivados das mutações condutoras já mencionadas. Correspondem a moléculas que estimulam a proliferação celular descontrolada (oncogenes) ou que param de suprimir a proliferação ou de estimular a apoptose quando mutados (genes supressores de tumor mutados). Uma dica para compreender melhor esses dois conceitos é pensar nos oncogenes como o acelerador de um carro, pois são moléculas que aceleram a proliferação da célula. Já os genes supressores de tumor seriam como os freios do carro, uma vez que impedem a proliferação da célula de acontecer ou de continuar. Quando esses genes são mutados, as células perdem seus “freios” e proliferam sem o devido controle. As mutações condutoras resultam em proteínas nucleares ou citosólicas que apresentam substituições de aminoácidos, deleções ou novas sequências de aminoácidos geradas pela translocação cromossômica, originando antígenos que são inéditos ou diferentes das formas originais não mutadas sendo, portanto, capazes de deflagrar a resposta imune.
Proteínas expressas de maneira aberrante ou superexpressas também são consideradas antígenos tumorais. Em alguns tumores humanos, o antígeno que deflagra a resposta imune é uma proteína não mutada, mas expressa em quantidade acima do normal em decorrência de duplicações ou alterações epigenéticas que ocorreram na região promotora de seu gene. A expressão aberrante de proteínas não mutadas também as torna imunogênicas. Um exemplo são as proteínas expressas apenas em tecidos fetais (antígenos oncofetais) ou células gaméticas, que passam a ser produzidas pelas células tumorais. Por último, nos tumores induzidos por vírus oncogênicos, antígenos virais são encontrados nas células transformadas e são reconhecidos como estranhos pelo sistema imune.
É valido destacar que qualquer um desses antígenos, para estimular as células T citotóxicas, deve ser apresentado pelas moléculas de MHC de classe I do indivíduo que tem o tumor.
Apesar do que vimos até aqui, o fato de que tumores malignos se desenvolvem em indivíduos imunocompetentes indica que a imunidade antitumoral é incapaz de prevenir o crescimento tumoral ou pode ser sobreposta por tumores mais agressivos. Não é à toa que a capacidade de evadir o sistema imune foi elencado como um dos hallmarks do câncer. Vários mecanismos utilizados pelos tumores para evitar a destruição por células imunes já foram descritos e um dos mais importantes é resultado da própria resposta imune contra o tumor.
Levando em consideração a heterogeneidade das células na massa tumoral, a expressão dos antígenos tumorais pode variar entre elas, conferindo graus distintos de imunogenicidade. Assim, o sistema imune age como uma força seletora, eliminando apenas as variantes mais imunogênicas. Já as variantes menos imunogênicas sobrevivem e acabam dominando a massa tumoral. Esse processo é chamado de imunoedição tumoral. Em adição à perda desses antígenos, alguns tumores diminuem a expressão de moléculas de MHC de classe I, impedindo o reconhecimento pelas células T citotóxicas. Geralmente, essa perda é resultado de mutações aleatórias nos genes para as moléculas de MHC de classe I ou outras moléculas envolvidas nessa via de apresentação antigênica. As variantes com tais mutações também acabam sendo selecionadas pelo processo de imunoedição tumoral.
A supressão ativa da resposta imune por células tumorais também é associada à evasão do sistema imune. Um exemplo é a expressão de moléculas PD-L1 observada em alguns tumores. Essa molécula é ligante do receptor inibitório expresso tanto por linfócitos TCD4+ quanto por linfócitos TCD8+ ativados, chamado de PD-1 (Programmed Cell Death Protein 1). A ligação do PD-1 com qualquer um dos seus agonistas (PD-L1 ou PD-L2), normalmente expressos pelas APCs, induz uma via de sinalização que culmina na inativação do linfócito T.
Além disso, os tumores, por serem persistentes, levam à estimulação crônica dos linfócitos, que passam a exibir um fenótipo exausto, caracterizado pela alta expressão de receptores inibitórios, como o próprio PD-1 e o CTLA-4. Fatores produzidos pelo microambiente tumoral colaboram para a supressão da resposta imune. Células dendríticas provenientes desses sítios tendem a expressar poucas moléculas da família B7, favorecendo a ligação com moléculas CTLA-4 expressas pelos linfócitos efetores. Alguns tumores são capazes, ainda, de induzir células T reguladoras ou influenciar a diferenciação de macrófagos para o perfil M2, com funções anti-inflamatórias, além de produzir citocinas com ações imunossupressoras, tal como o TGF-β.
Se juntarmos todos os pontos que discutimos até aqui, podemos dividir a relação entre o sistema imune e os tumores em três momentos distintos, de acordo com o modelo conhecido como os três “Es”: eliminação, equilíbrio e escape. Na fase de eliminação, a imunovigilância é eficaz e consegue controlar o crescimento da massa tumoral embora alguns clones menos imunogênicos sobrevivam. Na fase de equilíbrio, as células que escaparam da fase anterior, permanecem no organismo, mas têm a proliferação contida por mecanismos imunológicos, sendo incapazes de formar uma massa tumoral. Por fim, na fase de escape, os clones resultantes da imunoedição ocorrida nas fases anteriores passam a apresentar fenótipos que os permitem evadir a resposta imune. É nesta fase que se encontram a maioria dos tumores detectados clinicamente.
Você deve estar se perguntando... como tratar um tumor agressivo? Até recentemente a maioria dos protocolos de tratamentos disponíveis para cânceres metastáticos, que não poderiam ser eliminados por cirurgias, baseava-se na radioterapia ou na quimioterapia, abordagens que causam danos nos tecidos saudáveis e são associadas a uma alta toxicidade. Com os avanços no entendimento da relação entre o tumor e o sistema imune, além do fato das respostas imunes serem muito específicas, um novo campo da imunologia clínica vem ganhando força: a imunoterapia antitumoral.
Entre as diversas abordagens já em uso clínico desse campo, os anticorpos monoclonais específicos para antígenos tumorais são os mais amplamente usados. Podem atuar como carreadores de drogas citotóxicas ou de isótipos radioativos. Alguns monoclonais podem bloquear receptores que iniciam a sinalização de vias importantes para o crescimento tumoral, como o anti-Her2/Neu, usado em alguns casos de tumor de mama, e o anti-EGFR, usado em vários tumores, ou receptores envolvidos na angiogênese, como o receptor para o fator de crescimento endotelial vascular (VEGFR), usado em tumores de cólon. Outros monoclonais podem simplesmente se ligar às células tumorais e induzir a ADCC ou a fixação de complemento. Um grupo especial de anticorpos monoclonais foram desenvolvidos com o objetivo de bloquear os receptores inibitórios das células T ou seus ligantes expressos pelas células tumorais. Os bloqueadores dos checkpoints imunológicos, como são chamados, ligam-se a moléculas como o PD-1 ou o CTLA-4, impedindo que os linfócitos T sejam inativados pelo tumor. Anticorpos anti-PD-1 (Pembrolizumabe, Nivolumabe ou Atezolizumabe) e anti-CTLA-4 (Ipilimumabe) foram aprovados para o tratamento de melanomas metastáticos em 2011 e 2014, respectivamente. Os idealizadores dessa abordagem, Tasuku Honjo e James P. Allison, ganharam o Nobel de medicina em 2018.
Apesar das terapias baseadas em bloqueadores dos checkpoints imunológicos serem eficazes, apenas uma parcela dos pacientes responde ao tratamento. A razão para essa baixa resposta não é conhecida, mas pode estar relacionada à presença de outros mecanismos de evasão imunológica. Esse tratamento também não é livre de efeitos colaterais. Como tais receptores estão envolvidos na manutenção da tolerância imunológica, alguns pacientes apresentam danos autoimunes em órgãos como pele, coração, pulmão, cólon, entre outros.
A estimulação não específica do sistema imune utilizando moléculas inflamatórias já se mostrou efetiva em alguns modelos. A inoculação de extrato de BCG (bacilo de Calmette-Guérin) nos sítios tumorais foi testada por alguns anos. A BCG ativa a fagocitose por macrófagos e ajuda a estimular células T antitumorais. A utilização de citocinas inflamatórias segue o mesmo racional.
Reflita
Essa abordagem é parecida com outra já mencionada. Você recorda qual foi?
Outra abordagem que vem ganhando importância é a transferência adotiva de células T tumor-específicas. Células T específicas para antígenos tumorais são retiradas do paciente, estimuladas a proliferar in vitro e reinfundidas nele. A ideia é aumentar a frequência de clones citotóxicos nesses pacientes. Os resultados clínicos com essa abordagem ainda são inconsistentes e a efetividade, muitas vezes, esbarra na baixa expressão de MHC de classe I observada nos tumores mais agressivos. Uma modificação mais recente neste protocolo, entretanto, tem se mostrado promissora. Aqui, os linfócitos T são coletados do paciente que tem o tumor e são transfectados in vitro com vetores virais a fim de expressarem um receptor antigênico quimérico (CAR). Esse receptor é uma molécula “Frankstein”, normalmente construída a partir de uma cadeia única de imunoglobulina, cuja porção extracelular utiliza os domínios variáveis das cadeias leve e pesada, os quais juntos formam o sítio de interação com o antígeno tumoral de interesse. A cauda citoplasmática desse receptor possui domínios provenientes de moléculas coestimuladoras presentes no linfócito T e são responsáveis por iniciar as vias de ativação da célula que o expressa. Para ajudá-lo na visualização dessa molécula, confira a Figura 3.1.
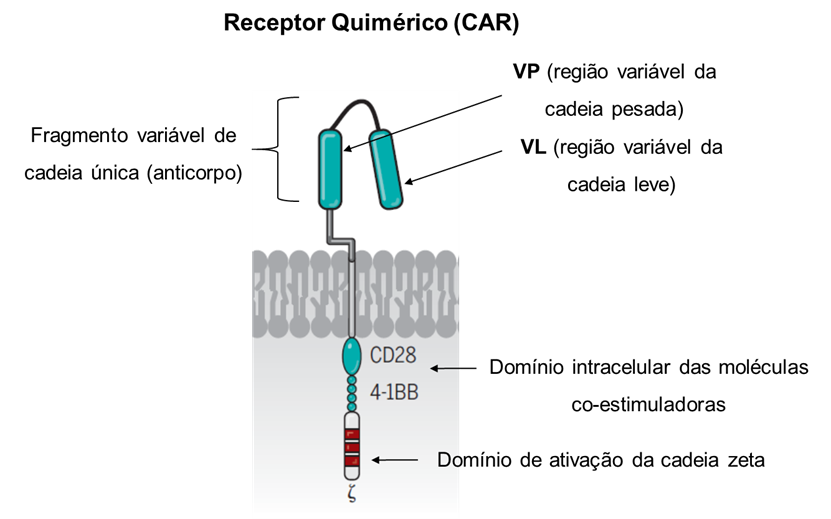
A especificidade dos TCRs apresentados pelos linfócitos T transfectados é irrelevante, pois é como se déssemos novos “olhos” para essas células. A escolha da estrutura dos anticorpos como o meio de reconhecimento dos receptores quiméricos não é à toa e permite a esses receptores reconhecerem o alvo para o qual são específicos, de maneira independente da sua apresentação via MHC.
As células T expressando o CAR (CAR-T cells) são expandidas in vitro e reinfundidas no paciente. Essa abordagem já se mostrou eficiente no tratamento de leucemias de células B refratárias a quimioterapia, por exemplo. O efeito colateral mais preocupante já observado em alguns pacientes é síndrome de liberação de citocinas, estimulada pela ativação em massa das células CAR-T quando encontram as células tumorais. Esse quadro é parecido com a tempestade de citocinas induzida por algumas infecções e, como tal, cursa com febre, edema tecidual, desordens neurológicas e até falência múltipla de órgãos. A severidade da síndrome pode ser mitigada pelo uso de anticorpos anticitocinas.
Outra forma que vem sendo desenvolvida para estimular as respostas antitumorais é a vacinação com antígenos tumorais. A ideia não é ser uma medida profilática, mas terapêutica. Dentre as várias propostas, a de maior potencial se baseia no desenvolvimento de vacinas personalizadas para o tumor de cada paciente. O método utiliza o sequenciamento do DNA para determinar todas as mutações presentes no genoma da célula tumoral. Em seguida, modelos computacionais são usados para predizer quais peptídeos derivados dessas mutações se encaixam melhor nas moléculas de HLA do paciente. Uma vez que é definido esse conjunto de antígenos, uma vacina personalizada utilizando tais antígenos é criada. Apesar de promissora, essa abordagem também apresenta limitações. O fato de ser personalizada encarece o método, além disso a vacina deve ser capaz de estimular uma resposta baseada na ação de células T citotóxicas e ser eficaz a ponto de ultrapassar os mecanismos de evasão imunológica que o tumor possa apresentar. A mistura de adjuvantes à vacina é um meio de conseguir isso. É valido lembrar que o desenvolvimento de tumores causados por vírus oncogênicos pode ser prevenido pela vacinação contra esses patógenos. Um exemplo são as vacinas contra os tipos mais oncogênicos do Papilomavírus humano (HPV tipos 6, 11, 16 e 18) que previnem o desenvolvimento de tumores de colo uterino.
Por fim, outra abordagem interessante é o isolamento de células dendríticas a partir do sangue periférico do paciente, seguida da exposição in vitro dessas células a antígenos tumorais provenientes do mesmo paciente. A ideia é ativar as células dendríticas longe de influência do microambiente tumoral para então reinfundi-las. A combinação dessa abordagem com a utilização de inibidores dos checkpoints imunológicos pode trazer resultados ainda melhores.
Terminamos aqui mais uma unidade. Olhe o quanto você já caminhou! Agora, pratique e até a próxima unidade!
Faça a valer a pena
Questão 1
Acredita-se que as células tumorais são formadas em indivíduos normais e, a seguir, destruídas por mecanismos efetores imunológicos normais, sem constatação ou consequência, durante toda a vida. Obviamente, esses mecanismos imunológicos nem sempre são bem-sucedidos. A esperança é que nosso crescente conhecimento sobre os mecanismos de defesa do hospedeiro e sobre o fenômeno da imunovigilância proporcione nova compreensão sobre prevenção e melhor tratamento do câncer (COICO e SUNSHINE, 2010).
Assinale a alternativa correta sobre os mecanismos imunológicos antitumorais.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Correto!
A primeira alternativa está incorreta, visto que os anticorpos também participam da resposta antitumoral, seja auxiliando na fagocitose das células tumorais, seja estimulado a fixação de complemento ou induzindo a ADCC.
A segunda alternativa está incorreta, pois a inflamação deflagrada pelo crescimento tumoral tem papel essencial na resposta imune contra o tumor.
A terceira alternativa está incorreta, pois a menor expressão de moléculas do MHC de classe I pelas células tumorais torna menos eficiente seu reconhecimento pelos linfócitos T citotóxicos.
A quarta alternativa está incorreta, pois o perfil Th2 está relacionado a uma pior resposta antitumoral.
Questão 2
De acordo com Macfarlane Burnet, a função fisiológica do sistema imune é reconhecer e destruir clones de células transformadas antes de originar tumores ou, no caso de tumores já estabelecidos, eliminá-los. Essa é a base do conceito de imunovigilância, desenvolvido por ele. A imunovilância tumoral depende, em última instância, do reconhecimento de antígenos tumorais que despertam os mecanismos imunes. Sobre os diferentes antígenos tumorais, analise as afirmativas a seguir:
I. Os neoantígenos são produtos de mutações condutoras (drive mutations), alterações no DNA que resultam na aquisição dos hallmarks do câncer.
II. Proteínas não mutadas, mas expressas em quantidades acima do normal pelas células tumorais são consideradas antígenos tumorais.
III. Os antígenos tumorais podem ser divididos naqueles que são tumor-específicos, únicos das células tumorais, e nos que são associados ao tumor, compartilhados entre as células tumorais e as células normais.
IV. Produtos de oncogenes ou de genes supressores de tumor mutados estão relacionados ao processo de malignização da célula e podem ser alvos de reconhecimento do sistema imunológico.
Considerando o contexto apresentado, assinale a alternativa correta.
Correto!
A primeira afirmativa está incorreta, visto que os neoantígenos são produtos de mutações passageiras que acontecem em genes diversos não relacionados ao processo de transformação tumoral. Essas mutações são reflexo da instabilidade genômica das células malignas.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Questão 3
Apesar da imunovigilância ser efetiva na maioria dos casos, o fato de que tumores malignos se desenvolvem em indivíduos imunocompetentes indica que a imunidade antitumoral é incapaz de prevenir o crescimento tumoral ou pode ser sobreposta por tumores mais agressivos. Não é à toa que a evasão do sistema imune foi elencada como um dos hallmarks do câncer.
Com base nos seus conhecimentos sobre a relação entre o sistema imune e o câncer, avalie as seguintes asserções e a relação proposta entre elas:
I. O próprio sistema imune antitumoral atua como uma força seletiva que gradualmente seleciona as células com maior potencial para evadir as respostas antitumorais, processo conhecido como imunoedição.
II. De acordo com o modelo dos três “Es”, a relação entre o sistema imune e o tumor evolui em três fases: eliminação, equilíbrio e escape. A última fase é resultado do acúmulo de mecanismos de evasão imunológicas apresentados pelas células tumorais.
A respeito dessas asserções, assinale a alternativa correta.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Correto!
A imunoedição é um processo gradual, ao longo de cujo desenvolvimento o sistema imune acaba delineando o tumor, o que favorece a fixação das células menos imunogênicas. Esse processo pode ser explicado pelo modelo dos três Es. Logo, as asserções I e II são proposições verdadeiras, mas a II não é uma justificativa da I.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Referências
ABBAS, A. K.; LICHTMAN, A. H.; PILLAI, S. Basic Immunology: Function and disorders of the imune system. 6. ed. Philadelphia: Elsevier, 2020.
ABBAS, A. K.; LICHTMAN, A. H.; PILLAI, S. Imunologia Celular e Molecular. 8. ed. Rio de Janeiro: Guanabara Koogan, 2015.
COICO, R.; SUNSHINE, G. Imunologia. Rio de Janeiro: Grupo GEN, 2010. Disponível em: https://bit.ly/36em9Dl. Acesso em: 18 abr. 2021.
HANAHAN, D.; WEINBERG, R. A. Hallmarks of cancer: the next generation. Cell, [S. l.], v. 144, n. 5, p. 646-674, 2011.
HANAHAN, D.; WEINBERG, R. A. The hallmarks of cancer. Cell, [S. l.], v. 100, n. 1, p. 57-70, 2000.
JUNE, C. H. et al. CAR T cell immunotherapy for human cancer. Science, New York, v. 359, n. 6382, p. 1361-1365, 2018.
ORGANIZAÇÃO MUNDIAL DA SAÚDE. Estimativas Globais de Saúde de 2019. Disponível em https://bit.ly/3hgLYJ3. Acesso em 02 Jul 2021.
SUNG, H. et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin., [S. l.], v. 71, n. 3, p. 209-249, 2021.
TEIXEIRA, H. C. et al. Proteínas de checkpoint imunológico como novo alvo da imunoterapia contra o câncer: revisão da literatura. HU rev., Juiz de Fora, v. 45, n. 3, p. 325-333, 2019. Disponível em: https://bit.ly/36fWE4s. Acesso em: 23 abr. 2021.



