lorem ipsum dolor sit amet
Lorem ipsum dolor sit amet, consectetur adipiscing elit. Nunc dignissim euismod urna tincidunt sagittis. Vivamus id vehicula eros, non scelerisque eros.
Fonte: Shutterstock.
Deseja ouvir este material?
Áudio disponível no material digital.
Praticar para aprender
Olá! Bem-vindo à última seção desta unidade. Parabéns por sua jornada até aqui!
Como estudante da área da saúde você já deve ter percebido a importância dos testes de imunodiagnóstico na prática clínica, não é mesmo? Especialmente no ano de 2020, em que a pandemia causada pelo vírus SARS-CoV-2 fez com que testes para a pesquisa de anticorpos IgM e IgG específicos se tornassem tão populares quanto necessários no rastreio da doença causada pelo vírus. Nunca se falou tanto em testes rápidos, ELISA e teste de quimioluminescência. Mas como saber qual é o melhor teste para cada situação? Quais as características técnicas que um teste deve apresentar para ser eficiente no diagnóstico de uma doença? Essas e outras perguntas serão respondidas no decorrer desta seção.
Mais uma vez, retomaremos o contexto de aprendizagem que discutíamos anteriormente. Em sua primeira participação na equipe multidisciplinar de um grande hospital, você já auxiliou em dois dos três casos apresentados. Um médico da equipe trouxe o terceiro caso a ser investigado. A paciente o havia procurado alegando ter tido contato com um parente testado positivo para o novo coronavírus. Mesmo com ausência de sintomas, a paciente realizou, por conta própria, o teste rápido para determinação de IgM e IgG específicos para o SARS-CoV-2. De acordo com o laudo, a paciente apresentava IgM reagente, com IgG não reagente. Frente a esse resultado, o médico informou a paciente sobre a possibilidade de ela estar no curso de uma infecção aguda/recente pelo novo coronavírus. Devido à ausência de sintomas, solicitou que ela fizesse total isolamento social, observasse o aparecimento de algum sintoma e, após 14 dias, realizasse um exame de ELISA para verificar a soroconversão. Durante esse período, a paciente não relatou quaisquer sintomas. Ao fim de duas semanas, repetiu o exame sorológico. Para surpresa do médico, o resultado do novo exame apontava que ambas as imunoglobulinas, IgM e IgG, não eram reagentes. O médico levou então o caso para a equipe a fim de que o ajudasse a entender o motivo dos testes terem dado resultados dissonantes. Será que a paciente havia mesmo se contaminado com o novo coronavírus? Baseado nos seus conhecimentos sobre os testes de imunodiagnóstico, como você explicaria o aparecimento transitório de IgM na paciente?
Nesta seção você aprenderá sobre a importância dos testes de imunodiagnóstico, além de entender quais os parâmetros técnicos necessários na sua validação para a prática clínica, as caraterísticas de cada técnica e as suas limitações. Ao final, você terá dado um importante passo rumo ao futuro profissional. Então, aproveite essa oportunidade. Bons estudos!
conceito-chave
Os testes de imunodiagnóstico exercem um papel fundamental no cuidado à saúde, visto que uma parcela significativa das decisões médicas é baseada em seus achados. Justamente por causa de sua importância é que devemos entender os fatores e características que os tornam válidos para serem aplicados à população.
Mas afinal de contas, você sabe o que é imunodiagnóstico? Quando falamos em diagnóstico definitivo de um quadro patológico, estamos nos referindo à demonstração de um marcador específico desse quadro, ou seja, algo que, sem dúvida, indique o agente causador da condição. Em um processo infeccioso, por exemplo, a identificação do patógeno ou de seus produtos na amostra do paciente nos dá o diagnóstico de certeza. Entretanto, nem sempre isso é possível, em razão da localização do agente em sítios de difícil acesso (como o encéfalo), da falta de métodos simples e seguros de isolamento ou cultura, ou do tempo necessário para a obtenção do resultado. Nesses e em muitos outros casos, os testes de imunodiagnóstico representam uma excelente alternativa, visto que se baseiam na especificidade da resposta imune para detectar o antígeno de interesse. Vale destacar que, aqui, a palavra antígeno ganha uma conotação mais ampla e pode refletir tanto um microrganismo quanto uma célula ou molécula, como fármaco, hormônio, ácido nucléico, citocina e até mesmo um anticorpo.
Os métodos de imunodiagnóstico podem ser divididos em dois tipos, de acordo com o que se pretende pesquisar na amostra. Os métodos diretos são aqueles que buscam identificar o antígeno. Já os indiretos se baseiam na procura por anticorpos específicos para o antígeno. Não se esqueça de que um linfócito B só se diferencia em plasmócitos e secreta anticorpo após o contato com o antígeno. Logo, a presença de anticorpos específicos na amostra indica, indiretamente, que o paciente está ou já entrou em contato com esse antígeno.
Contudo, os resultados obtidos nesses testes podem variar em função de alguns fatores, entre eles a resposta imune do hospedeiro, variações antigênicas (principalmente em casos de patógenos e tumores) ou também sensibilidade dos reagentes utilizados. Tudo isso pode ocasionar resultados falsos. A fim de minimizá-los, alguns parâmetros devem ser analisados para se comprovar a eficiência dos testes de imunodiagnóstico e para que sejam uma alternativa viável se comparados a outros métodos.
O primeiro passo é a validação do teste, ou seja, a determinação do quanto, em termos quantitativos, ele é útil para diagnosticar um evento ou predizê-lo. Os vários parâmetros que devem ser analisados para validar um teste podem ser agrupados naqueles relacionados à sua validade intrínseca ou à sua validade extrínseca.
A validade intrínseca refere-se ao desempenho do teste quando comparado a um teste de referência, chamado de padrão-ouro. Para tanto, indivíduos doentes e não doentes (de acordo com resultados obtidos no teste padrão-ouro) são avaliados pelo teste que se quer validar. O ideal é que haja uma compatibilidade de resultados em 100% dos casos. No entanto, é comum que se apresente uma combinação binária entre os resultados possíveis: 1. Verdadeiro positivo (VP), quando o teste é positivo na presença da doença; 2. Falso positivo (FP), quando o teste é positivo na ausência da doença; 3. Verdadeiro negativo (VN), quando o teste é negativo na ausência da doença; e 4. Falso negativo (FN), quando o teste é negativo na presença da doença. Os resultados são comparados de acordo com os parâmetros de sensibilidade, especificidade e eficiência. Como são parâmetros relacionados ao teste e não à população em que está sendo aplicado, seus valores não serão influenciados pela prevalência da doença.
Assimile
O parâmetro sensibilidade refere-se ao percentual de resultados positivos indicados pelo teste dentro da população doente. Ou seja, está relacionado aos resultados verdadeiros positivos (VP). Quanto maior a sensibilidade, maior o poder do teste de detectar a condição ou doença. Em contrapartida, falhas na sensibilidade levam ao aumento de resultados falsos negativos (FN). Já a especificidade refere-se à porcentagem de resultados negativos dentro da população não doente, ou seja, o número de resultados verdadeiros negativos (VN). Testes com alta especificidade são úteis no correto diagnóstico de pacientes que apresentam sintomas similares, mas não a doença ou condição. Falhas na especificidade levam ao aumento de resultados falsos positivos (FP). Finalmente, o parâmetro eficiência refere-se à porcentagem de resultados corretos do teste, isto é, o somatório dos resultados verdadeiros positivos e verdadeiros negativos.
É importante destacar que não existe, atualmente, nenhum teste que apresente eficiência de 100%, embora alguns alcancem percentuais próximos a esse valor.
E quanto à validade extrínseca de um teste? Bem, ela está relacionada à capacidade de um teste detectar a doença na população e ao seu desempenho em tal tarefa. Podemos avaliá-la por meio de outros três parâmetros. O primeiro é a precisão, que mede a concordância entre os resultados obtidos ao se realizar o teste várias vezes. A acurácia ou exatidão determina o quão próximo dos valores verdadeiros os resultados de um teste estão. Mas tenha cuidado, pois apesar de parecerem a mesma coisa, precisão e acurácia são parâmetros distintos. Ou seja, mesmo medidas repetidas que forneceram resultados bastante semelhantes (e que, por isso, são precisos) podem estar, em sua totalidade, significativamente distantes do valor real (baixa acurácia). Por fim, a reprodutibilidade refere-se à obtenção de resultados iguais em testes realizados com a mesma amostra, porém por pessoas diferentes e em locais distintos.
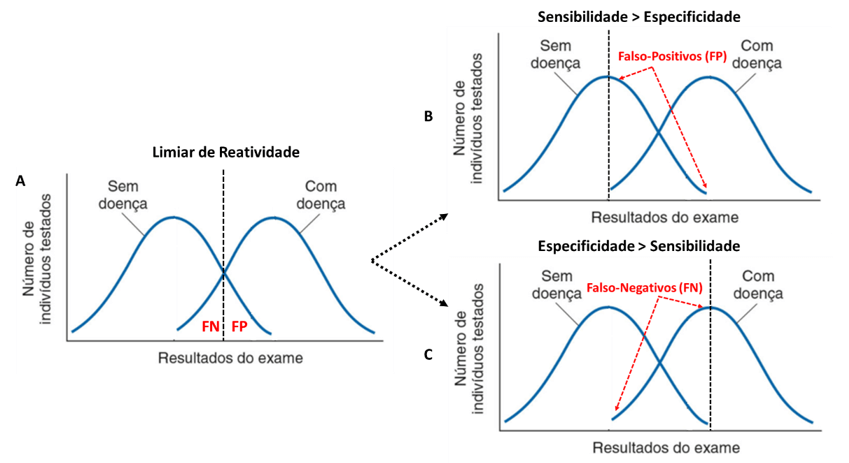
Além das validades intrínseca e extrínseca do teste, um ponto fundamental à sua correta aplicação no diagnóstico de um quadro é o estabelecimento do limiar de reatividade ou cut off. Isto é, o ponto de corte entre a população doente e não doente. Na prática, refere-se ao valor obtido em um teste, a partir do qual os resultados são considerados positivos para a doença e abaixo do qual os resultados são negativos. Você deve ter em mente que são maiores as chances de ocorrer um resultado falso positivo ou falso negativo quando a amostra apresenta valores muito próximos ao limiar. Para você entender melhor, observe a Figura 1.3, gráfico A. A linha pontilhada representa o limiar de reatividade de um dado teste.
Exemplificando
Sabendo que existem resultados falsos negativos e falsos positivos com valores próximos ao limiar de reatividade, podemos diminuir a ocorrência de um ou de outro deslocando o limiar em diferentes direções (Figura 1.3, gráficos B e C). Se o deslocarmos para a direita, aumentaremos a sensibilidade do teste, diminuindo ao máximo os resultados falsos negativos. Em contrapartida, haverá a diminuição da especificidade. Mas, se o deslocarmos para a esquerda, iremos aumentar a especificidade do teste, eliminando os resultados falsos positivos, em detrimento da sensibilidade. Esse deslocamento ajuda a adequar o teste ao tipo de laboratório que irá utilizá-lo.
Agora que falamos dos parâmetros relativos ao teste, é importante saber que fatores relacionados ao paciente e à amostra também podem contribuir para a obtenção de resultados falsos, especialmente em testes de imunodiagnóstico. Conforme já mencionado, esses testes se baseiam, principalmente, na procura por antígenos ou anticorpos na amostra. Para uma análise correta, o ideal é que a concentração de ambos seja equivalente, ou melhor, que eles estejam na zona de equivalência. No entanto, uma concentração mais elevada de anticorpos em relação ao antígeno resulta na inibição da ligação entre essas moléculas, um efeito chamado de prozona, levando a resultados falsos negativos. Caso o excesso de anticorpos esteja na amostra, recomenda-se diluí-la.
Reflita
Acabamos de ver que o efeito prozona pode ocasionar resultados falsos negativos em testes de imunodiagnóstico. Mas você saberia como diferenciar um resultado verdadeiro negativo de um falso negativo por efeito prozona?
Outro fator que pode ocasionar resultados falsos são os anticorpos heterofilos, resultados da ativação policlonal de linfócitos B. Esses anticorpos costumam ter baixa especificidade e podem fazer reações cruzadas com antígenos diferentes, levando a resultados falsos positivos. Um exemplo que podemos citar é o fator reumatoide, um anticorpo que reconhece a porção Fc de anticorpos IgG. Muito comum em pacientes que sofrem de doenças autoimunes, em especial artrite reumatoide, esse fator também pode ser encontrado em baixas concentrações no soro de indivíduos saudáveis.
Finalmente, temos o período de janela imunológica, muito comum em casos de infecções. Por definição, janela imunológica compreende o período que vai do início da infecção até o aparecimento do primeiro marcador sorológico. Resultados de testes feitos nesse período serão falsos negativos. Mas não pense que esse período é fixo, pois ele depende de inúmeros fatores que vão desde a resposta imune do paciente e o ciclo de infecção do microrganismo até a sensibilidade do teste. Os testes iniciais para detecção do HIV, vírus da imunodeficiência adquirida, por exemplo, apresentavam um período de janela imunológica de seis meses. Com os testes mais novos, esse período caiu para 4 semanas, em média.
Você deve estar se perguntando: afinal, quais são os testes de imunodiagnóstico? Os testes são divididos em dois grupos básicos: os mais clássicos, que não utilizam reagentes marcados, ou seja, que possibilitam observar, de forma visual ou por microscopia, os imunocomplexos formados entre o antígeno e o anticorpo; e aqueles que utilizam reagentes marcados, nos quais reagentes enzimáticos, fluorescentes ou quimioluminescentes sinalizam a ligação entre o antígeno e o anticorpo. A seguir, você encontrará a descrição de alguns desses métodos.
Testes de precipitação
São técnicas fundamentadas na quantificação de precipitados formados pela ligação de antígenos solúveis e anticorpos. Dentre as técnicas de precipitação mais conhecidas, destaca-se a imunodifusão. Nela é utilizado um meio gelificado, como ágar, por exemplo. Em geral, os poros do gel são maiores que as partículas que se quer analisar, permitindo que elas se difundam por ele. Se colocarmos antígenos e anticorpos específicos em pontos distintos do gel e esperarmos o tempo suficiente, ambas as moléculas irão se difundir pela malha e, no ponto onde se encontrarem, irão se ligar e precipitar, formando um halo esbranquiçado no local. É exatamente assim que funciona a imunodifusão dupla de Ouchterlony, um teste qualitativo que permite identificar se na amostra do paciente existem anticorpos específicos para o antígeno de interesse ou se essa amostra tem o antígeno de interesse.
Uma variação dessa técnica é a imunodifusão radial simples, na qual costuma-se misturar ao ágar uma diluição apropriada de anticorpo específico para determinado antígeno. A mistura é, então, colocada em uma placa de Petri e orifícios são feitos para a aplicação da amostra do paciente e para a aplicação de, pelo menos, três concentrações diferentes do antígeno obtido comercialmente. Após um período de incubação, o antígeno irá difundir-se pelo gel em todas as direções, formando um halo circular de precipitação, cujo diâmetro será relacionado à concentração do antígeno. Assim, ao compararmos o diâmetro do halo formado pela amostra a ser analisada com o diâmetro dos halos formados pelas diluições de concentração conhecida do antígeno comercial, saberemos a concentração do antígeno na amostra. Trata-se, portanto, de uma técnica qualitativa e quantitativa.
Testes de aglutinação
Os métodos de aglutinação se baseiam na interação de anticorpos específicos com partículas que contêm determinantes antigênicos em sua superfície. Após o contato, os anticorpos ligados a uma partícula se ligam a determinantes antigênicos de outra, entrelaçando essas partículas. Lembre-se de que a estrutura do anticorpo permite sua ligação com dois antígenos iguais ao mesmo tempo. Ao fim do processo, formam-se agregados visíveis a olho nu. Existem inúmeros testes baseados nesse método. No teste de aglutinação direta, por exemplo, utilizam-se partículas antigênicas na sua forma íntegra ou fragmentada, tais como hemácias, bactérias e fungos, que são aglutinadas diretamente por anticorpos. Aqui, o antígeno faz parte naturalmente da partícula que será aglutinada. A tipagem de grupos sanguíneos do sistema ABO e Rh, o teste de Wright para diagnóstico de brucelose, o teste de Widal para salmoneloses e a microaglutinação para leptospirose ou toxoplasmose são exemplos de aglutinação direta. O teste de inibição da hemoaglutinação direta é uma variação da técnica original e baseia-se na capacidade de alguns vírus induzirem, espontaneamente, a aglutinação das hemácias. Se a incubação prévia das partículas (ou antígenos) virais, obtidas comercialmente, com a amostra a ser testada impedir a aglutinação das hemácias, entende-se que há anticorpos específicos para o vírus nessa amostra. Testes de inibição da hemoaglutinação direta são usados na detecção de anticorpos contra os vírus influenza, rubéola e sarampo, entre outros.
Nos testes de aglutinação passiva o antígeno é adsorvido artificialmente às partículas (inertes) que serão aglutinadas. São inúmeros os tipos de partículas que podem ser utilizadas como suporte do antígeno, sendo os mais comuns, no entanto, hemácias e látex. Devido à enorme variedade de antígenos que podem ser ligados a essas partículas, a aplicação desses testes é bastante diversa. Os testes desse tipo são nomeados de acordo com a partícula utilizada. Nos testes de hemoaglutinação passiva, hemácias humanas do tipo O ou hemácias de carneiro, pré-tratadas com ácido tânico, são usadas para adsorção do antígeno de interesse. As hemácias estão entre os melhores suportes para antígenos, devido à grande quantidade de antígenos que podem ser adsorvidos em sua superfície, fornecendo um sistema indicador muito sensível para a pesquisa de anticorpos específicos. A formação de agregados quando as hemácias entram em contato com a amostra a ser analisada indica a presença, na amostra, de anticorpos específicos para o antígeno adsorvido na hemácia. A inibição da hemoaglutinação passiva é uma variação desse método, sendo bastante utilizada na detecção de quantidades muito pequenas do antígeno solúvel ou de anticorpos. O princípio do teste baseia-se na competição pelos sítios de ligação do anticorpo (comercial), entre o antígeno solúvel e aquele fixado nas hemácias. Quanto maior a concentração do antígeno solúvel na amostra analisada, menos anticorpos livres para aglutinar as hemácias restarão. Logo, a ausência de aglutinação indica um teste positivo para a presença do antígeno na amostra. Por fim, temos os testes de aglutinação em látex, esferas de poliestireno que podem ser utilizadas como suportes para a adsorção de proteínas solúveis ou polissacarídeos, fornecendo um ótimo (e barato) sistema indicador da reação antígeno-anticorpo. O teste pode ser aplicado para detecção de fator reumatoide e de hormônios como a β-gonadotrofina coriônica humana, ou para pesquisa de anticorpos na rubéola e de proteína C reativa.
Testes de imunofluorescência
São testes utilizados para a pesquisa de anticorpos ou antígenos por meio de anticorpos poli ou monoclonais, conjugados a fluorocromos, moléculas que emitem luz fluorescente quando excitadas por uma luz de alta energia. Note que a conjugação do fluorocromo ao anticorpo não atrapalha o reconhecimento antigênico. Os testes de imunofluorescência podem ser divididos em direto e indireto. No teste direto, o anticorpo conjugado é adicionado diretamente sobre a amostra que se quer analisar. O anticorpo se fixa ao antígeno de forma estável, não sendo removido pelas sucessivas lavagens posteriores. Por ser bastante empregada na imunocitoquímica para a demonstração de antígenos em células e tecidos, a análise da fluorescência emitida é realizada através de um microscópio de fluorescência. Já os testes indiretos têm sido mais frequentemente usados para amplificar o sinal e aumentar a sensibilidade do método. Neste tipo, usa-se um anticorpo não conjugado específico para o antígeno e um anticorpo de revelação específico para o primeiro anticorpo. Ou seja, se o anticorpo monoclonal específico para o antígeno foi produzido em camundongo, conforme vimos na aula passada, o anticorpo de revelação será uma anti-imunoglobulina murina conjugada a um fluoróforo. Essa disposição acabou por baratear o método, pois o mesmo anticorpo revelador pode ser usado para diferentes fins. Os testes indiretos podem ser subdividir em dois tipos, de acordo com o que se pesquisa na amostra. No teste para pesquisa de antígeno, a célula ou o tecido em que se quer pesquisar o antígeno é incubado com o anticorpo específico e, após a lavagem, revela-se a presença do primeiro anticorpo por meio do anticorpo revelador. Já para pesquisa de anticorpo, antígenos padronizados são fixados em lâminas de vidro. O soro do paciente é diluído, colocado sobre o antígeno e incubado para que se formem os imunocomplexos. Após a lavagem, é adicionado o anticorpo de revelação e, havendo anticorpos específicos no soro do paciente, haverá emissão de luz fluorescente quando a lâmina for observada no microscópio. Essa técnica permite ainda detectar anticorpos específicos de uma determinada classe ou subclasse, bastando, para tanto, utilizar um anticorpo de revelação específico para ela, como anti-IgM ou anti-IgG1, por exemplo.
Testes imunoenzimáticos
São métodos que se baseiam na utilização de antígenos ou anticorpos conjugados a enzimas cujos substratos, após a clivagem catalítica, precipitam ou induzem uma mudança na cor do meio onde se encontram. Dos vários tipos descritos, o ELISA (enzyme-linked immunosorbent assay) é o teste mais utilizado atualmente na clínica para os mais variados diagnósticos. Baseia-se na imobilização de um dos reagentes na fase sólida (em geral, placas de poliestireno ou afins), de modo a capturar a molécula de interesse na amostra analisada. A identificação do complexo formado é realizada por meio de um conjugado enzimático que, na presença do substrato específico, altera a coloração do meio. Devido à alta sensibilidade, especificidade, rapidez, simplicidade técnica e adaptação a automação, o ELISA atualmente pode ser empregado para detecção de antígenos ou anticorpos. No ELISA de captura ou sanduíche a placa é recoberta (sensibilizada) com anticorpos específicos para o antígeno, chamados de anticorpos de captura, e, em seguida, a amostra do paciente é adicionada. Caso a amostra apresente os antígenos, eles serão capturados pelos anticorpos da placa e ficarão ali retidos. Adiciona-se então um anticorpo antígeno-específico (anticorpo de revelação) conjugado a uma enzima, como peroxidase, por exemplo. A reação é revelada ao se adicionar o substrato que, ao ser degradado, altera a cor do meio. A intensidade da cor gerada será proporcional à concentração do antígeno. Entre cada uma das etapas, a placa deve ser lavada para remoção dos reagentes não fixados. Perceba que o nome da técnica remete ao fato de que o antígeno da amostra ficará no meio entre dois anticorpos específicos para ele: o de captura e o de revelação.
Já no ELISA direto a amostra do paciente é aplicada na placa, de modo que o antígeno, se presente, seja fixado na placa. Após incubação e lavagem, é adicionado o anticorpo de revelação específico para o antígeno. A reação é revelada da mesma forma como no exemplo anterior.
Outra variação do teste ELISA é o chamado ELISA indireto. Aqui, usa-se o antígeno purificado para sensibilizar a placa, visando a captura de anticorpos específicos na amostra do paciente. Novamente utiliza-se um anticorpo de revelação, dessa vez específico para a porção Fc de anticorpos humanos. Da mesma forma como vimos para a imunofluorescência, podemos detectar anticorpos específicos de uma determinada classe ou subclasse.
Enzimaimunoensaio quimioluminescente
O princípio básico desse imunoensaio é o mesmo que comentamos anteriormente para o ELISA. A principal diferença, no entanto, é o sistema revelador. Aqui, a enzima do conjugado, ao atuar sobre o seu substrato, gera energia luminosa que pode ser detectada por um leitor específico. A peroxidase continua a ser a enzima mais utilizada, porém um dos substratos usados é o luminol.
Ensaios imunocromatográficos (testes rápidos)
São testes que utilizam uma membrana de nitrocelulose como fase sólida. Nela são fixados, em linha (linha teste), o antígeno de interesse (nos testes em que se busca por anticorpos específicos na amostra) ou anticorpos específicos (nos testes em que se procura pelo antígeno na amostra). Existe ainda uma linha controle de reagentes. A amostra do paciente é adicionada em um ponto da membrana e cria-se um fluxo por capilaridade, fazendo com que essa amostra percorra toda a extensão da membrana até as linhas teste e controle. Havendo a molécula de interesse na amostra, ela ficará retida na linha teste. A revelação é feita por corantes coloidais ou enzimáticos. Na presença de duas linhas visíveis na membrana, o teste é considerado positivo. Apenas a linha controle aparente indica um teste negativo. Entre a execução, leitura e interpretação dos resultados gasta-se, no máximo, 30 minutos. Um exemplo de teste rápido bastante conhecido é o de gravidez, específico para o hormônio gonadotrofina coriônica humana.
Nesta seção você conheceu os testes de imunodiagnóstico. Eles constituem hoje uma valiosa ferramenta para o diagnóstico de inúmeras patologias. Entender seu funcionamento, suas qualidades e limitações será imprescindível para o seu futuro profissional. Agora é com você! Se aprofunde no assunto, leia mais sobre ele e boa sorte!
Faça valer a pena
Questão 1
Os testes de imunodiagnóstico compreendem uma ferramenta imprescindível na prática clínica atualmente. Podem ser divididos em dois grupos básicos: os mais clássicos, que não utilizam reagentes marcados, e aqueles que utilizam reagentes marcados para visualizar a formação do complexo antígeno-anticorpo.
Com base em seus conhecimentos sobre as técnicas de imunodiagnóstico, marque a opção que relaciona corretamente a técnica com a sua descrição.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Correto!
A única opção que relaciona corretamente a técnica com a sua descrição é a letra e. Na letra a, temos a descrição da técnica de precipitação; letra b, técnica de aglutinação; letra c, técnica de imunofluorescência e letra d, técnica imunoenzimática.
Questão 2
A amostra de um paciente foi testada para o diagnóstico de uma doença infecciosa pelo método de aglutinação passiva com esferas de látex. O objetivo foi identificar na amostra testada anticorpos específicos para o patógeno em questão. Para a realização do exame, foram utilizados o soro não diluído do paciente e as seguintes diluições: 1:2, 1:4, 1:8 e 1:16. Após a incubação, só foi observada a aglutinação das esferas quando testadas com as amostras diluídas 1:8 e 1:16.
Qual a causa do fenômeno que você observou?
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Correto!
A janela imunológica refere-se ao período compreendido entre o início da infecção e o aparecimento do primeiro marcador sorológico, ocasionando resultados falsos negativos nesse período. A presença de anticorpos heterofilos resulta em reações cruzadas que levam a resultados falsos positivos. Já o efeito prozona está relacionado à ausência de reação antígeno-anticorpo devido a uma concentração elevada de anticorpos. Para evitá-lo, recomenda-se diluir a amostra a ser testada, conforme a questão mencionou. O excesso de látex e o erro técnico podem ser descartados, pois os resultados obtidos com as diluições da amostra demonstram tratar-se de efeito prozona.
Questão 3
A validade intrínseca de um teste refere-se ao seu desempenho quando comparado a um teste de referência. Como está relacionada às características do teste e não da população em estudo, sua análise fornece resultados consistentes independentemente da prevalência da doença. Os parâmetros utilizados na determinação da validação intrínseca são a sensibilidade, a especificidade e a eficiência. Sobre esses parâmetros, analise as afirmativas a seguir:
I. Os resultados falsos positivos geralmente apresentam valores mais altos que os resultados verdadeiros positivos.
II. A diluição da amostra a ser testada tende a aumentar a especificidade e reduzir a sensibilidade.
III. A especificidade refere-se à porcentagem dos indivíduos com determinada condição/doença para os quais, se o teste for utilizado, se obtém resultados positivos.
IV. A sensibilidade refere-se à porcentagem dos indivíduos que não têm a condição/doença e, ao utilizar-se do teste, obtêm resultados negativos.
Considerando seus conhecimentos sobre o assunto, é correto o que se afirma em:
Correto!
A sensibilidade de um teste refere-se aos resultados verdadeiros positivos, enquanto a especificidade refere-se aos resultados verdadeiros negativos. Geralmente, resultados falsos negativos ou falsos positivos apresentam valores muito próximos ao limiar de reatividade, ou seja, próximos do ponto de corte entre as populações saudável e doente para uma dada condição. Considerando o que foi levantado, a única afirmativa correta é a II, visto que a diluição da amostra pode favorecer a especificidade de um teste, embora possa diminuir a concentração da molécula que se procura para um valor abaixo do limite de detecção do teste, influenciando sua sensibilidade.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Tente novamente...
Esta alternativa está incorreta, leia novamente a questão e reflita sobre o conteúdo para tentar outra vez.
Referências
FERREIRA, A. W.; MORAES, S. L. Diagnóstico Laboratorial das Principais Doenças Infecciosas e Autoimunes. 3. ed. Rio de Janeiro: Guanabara Koogan, 2018.
NICOLL, D.; MARK LU, C.; MCPHEE, S. J. Manual de Exames Diagnósticos. 7. ed. Porto Alegre: AMGH editora LTDA, 2019.
VAZ, A. J., MARTINS, J.O., TAKEI, K., BUENO, E.C. Ciências Farmacêuticas - Imunoensaios: fundamentos e aplicações. 2. ed. Rio de Janeiro: Guanabara Koogan, 2018. Disponível em: https://bit.ly/3ixV3hM. Acesso em: 9 fev. 2021.



